Fluida adalah zat yang dapat mengalami perubahan bentuk secara kontinu bila terkena tegangan geser walaupun relatif kecil. Gaya geser adalah komponen gaya yang menyinggung permukaan dan jika dibagi dengan luas permukaan tersebut menjadi tegangan geser rata-rata pada permukaan itu. Atau zat yang secara permanen tidak dapat menahan gaya geser yang dikenakan terhadap zat tersebut.
Dalam keadaan diam atau dalam keadaan keseimbangan, fluida tidak mampu menahan gaya geser yang bekerja padanya, dan oleh sebab itu fluida mudah berubah bentuk tanpa pemisahan massa.
Fluida dapat terbagi menjadi dua macam, yaitu gas dan cairan yang mempunyai perbedaan sifat, yaitu :
Gas tidak mempunyai permukaan bebas dan massanya selalu berkembang mengisi seluruh ruangan, serta mampu dimampatkan (compressible).
Dalam keadaan diam atau dalam keadaan keseimbangan, fluida tidak mampu menahan gaya geser yang bekerja padanya, dan oleh sebab itu fluida mudah berubah bentuk tanpa pemisahan massa.
Fluida dapat terbagi menjadi dua macam, yaitu gas dan cairan yang mempunyai perbedaan sifat, yaitu :
Gas tidak mempunyai permukaan bebas dan massanya selalu berkembang mengisi seluruh ruangan, serta mampu dimampatkan (compressible).
Cairan mempunyai permukaan bebas, massanya akan mengisi volume ruangan tertentu sesuai dengan volumenya, serta tidak mampu dimampatkan (incompressibel).
Sifat - sifat Fisik Fluida :
Sifat - sifat Fisik Fluida :
- Densitas ρ = m/v
- Specific Grafity sg = densitas / densitas air pada T dan P tertentu
- Viskositas yaitu ketahanan suatu fluida untuk mengalir atau berubah bentuk. F/A = -µ ((dυ/∆y))
- Viskositas Kinematis (Centistoke) V = µ/ρ
Statika Fluida
Tekanan rata - rata (P) = gaya F yang bekerja pada permukaan / luas pemukaan
dimana : F = m . a
Tekanan hidrostatik kolom cairan setinggi h dengan rapat massa ρ adalah P = ρ . g. h
Tegangan Permukaan
Penyebab timbulnya tegangan permukaan adalah gaya tarik antar molekul dalam zat cair. Tegangan permukaan untuk suatu permukaan air-udara adalah 0,073 N/m pada temperatur ruangan. Adanya tegangan permukaan tersebut menaikkan tekanan di dalam suatu tetesan cairan. Untuk suatu tetesan cairan dengan diameter D, tekanan interbal p diperlukan untuk mengimbangi gaya tarik karena tegangan permukaan σ, dihitung berdasarkan gaya yang bekerja pada suatu belahan tetesan cairan.
cairan merupakan zat yang tidak termampatkan (incompressible). Namun perlu diperhatikan bahwa cairan dapat berubah bentuk karena tegangan geser atau termampatkan oleh tekanan pada suatu volume cairan tersebut. Dengan demikian maka untuk kondisi-kondisi dimana terjadi perubahan tiba-tiba atau perubahan besar dalam tekanan maka kemampatan cairan menjadi penting. Kemampatan dinyatakan dengan harga K.
Harga K untuk air pada temperatur 20oC adalah sekitar 2,18 x 109N/m2 pada tekanan atmosfer dan bertambah secara linier sampai sekitar 2,86 x 109N/m3 pada suatu tekanan 1000 atmosfer jadi dalam kondisi pada temperatur 20oC.
dimana P adalah tekanan terukur (gage pressure) dalam N/m2. Untuk keperluan praktis air dapat dipertimbangkan sebagai cairan tak termampatkan (incompressible fluid). Namun ada pengecualiannya, yaitu fenomena water hammer yang terjadi di dalam saluran tertutup apabila terjadi penutupan katub turbin secara tiba-tiba.
dimana :
K = modulus elastisitas
dp = penambahan tekanan
dV = pengurangan volume
V = volume awal
Tanda (-) di dalam persamaan tersebut menunjukkan bahwa pertambahan tekanan mengurangi volume.
Karena dV/V tidak berdimensi maka : K dinyatakan dalam satuan dari tekanan p atau gaya tiap satuan luas. Apabila yang dipertimbangkan adalah satuan massa cairan, maka modulus elastisitas K dapat dinyatakan dalam persamaan :
Karena ρV = tetap dan d(ρV) = 0 atau dV/V = -dρ/ρ
Kapilaritas
Kapilaritas terjadi disebabkan oleh tegangan permukaan oleh gaya kohesi dan adhesi. hal ini dapat dilihat dari suatu pipa vertikal diameter kecil (pipa kapiler) yang dimasukkan ke dalam suatu cairan.
Keseimbangan tercapai apabila :
Sehingga kenaikan kapilaritas dapat dihitung yaitu :
(Persamaan diatas berlaku untuk d < 3 mm)
dimana :
h = tinggi kenaikan kapilaritas (m)
σ = tegangan permukaan (N/m2)
ρ = kerapatan cairan (kg/m3)
g = gaya grafitasi (m/s2)
d = diameter pipa kapiler (m)
Ѳ = sudut antara tegangan permukaan dan dinding pipa vertikal
Tekanan
Tekanan fluida yaitu gaya fluida yang bekerja pada arah tegak lurus pada satuan luas permukaan P = F/A
Tekanan Uap
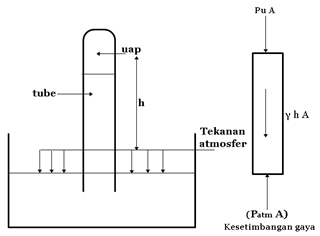
Salah satu cara untuk menjelaskan besarnya tekanan uap, diambil suatu pipa diamter kecil berisi cairan yang ditutup di salah satu ujungnya (tube). Ujung yang satu lagi terbuka dan dibenamkan di dalam suatu bak berisi cairan yang sama dengan cairan di dalam pipa, seperti pada gambar di bawah ini.
Tekanan atmosfer menahan menahan kolom cairan di dalam pipa, tetapi apabila pipa ditarik lebih tinggi, tekanan di ujung atas pipa menurun sampai di bawah tekanan uap. Dalam hal ini cairan akan melepaskan diri dari ujung pipa. Dengan tekanan pada permukaan dasar pipa sama dengan tekanan atmosfer, Keseimbangan gaya dapat digunakan untuk menunjukkan hubungan antara tekanan uap, tekanan atmosfer dan panjang dari kolom cairan :
Gaya, Massa dan Berat
Gaya adalah dorongan / pendorong yang dapat menyebabkan benda bergerak dari suatu tempat ketempat lainnya.
Massa adalah ukuran jumlah suatu materi.
Berat adalah gaya yang disebabkan oleh gaya grafitasi
dimana :
Percepata Grafitasi = gc = 32,174 lbm . ft/lbf . s2 (faktor konversi)
jadi percepatan grafitasi = g = 32,174 ft/s2
Contoh :
Sebuah benda dengan berat 200 lbf berada disuatu tempat dibumi yang mempunyai percepatan grafitasi sebesar 32,2 ft/s2 . Berapakah berat benda tersebut dipermukaan bulan yang memiliki percepatan grafitasi 5,47 ft/s2
Jawab :
F = (m. g)/gc
m = (F . gc)/g = (200 x 32,174)/32,2 = 199,84 lb
F = (m . g)/gc = (199,84 x 5,47)/32,174 = 33,97 lbf
Tekanan Relatif (Gage/Gaoge)
Tekanan Relatif adalah tekanan didalam sistem tersebut, dengan tidak menyertakan besarnya tekanan atmosfer.
Tegangan Permukaan
Penyebab timbulnya tegangan permukaan adalah gaya tarik antar molekul dalam zat cair. Tegangan permukaan untuk suatu permukaan air-udara adalah 0,073 N/m pada temperatur ruangan. Adanya tegangan permukaan tersebut menaikkan tekanan di dalam suatu tetesan cairan. Untuk suatu tetesan cairan dengan diameter D, tekanan interbal p diperlukan untuk mengimbangi gaya tarik karena tegangan permukaan σ, dihitung berdasarkan gaya yang bekerja pada suatu belahan tetesan cairan.
cairan merupakan zat yang tidak termampatkan (incompressible). Namun perlu diperhatikan bahwa cairan dapat berubah bentuk karena tegangan geser atau termampatkan oleh tekanan pada suatu volume cairan tersebut. Dengan demikian maka untuk kondisi-kondisi dimana terjadi perubahan tiba-tiba atau perubahan besar dalam tekanan maka kemampatan cairan menjadi penting. Kemampatan dinyatakan dengan harga K.
Harga K untuk air pada temperatur 20oC adalah sekitar 2,18 x 109N/m2 pada tekanan atmosfer dan bertambah secara linier sampai sekitar 2,86 x 109N/m3 pada suatu tekanan 1000 atmosfer jadi dalam kondisi pada temperatur 20oC.
K = (2,18 x 109 + 6,7 P) N/m2
dimana :
K = modulus elastisitas
dp = penambahan tekanan
dV = pengurangan volume
V = volume awal
Tanda (-) di dalam persamaan tersebut menunjukkan bahwa pertambahan tekanan mengurangi volume.
Karena dV/V tidak berdimensi maka : K dinyatakan dalam satuan dari tekanan p atau gaya tiap satuan luas. Apabila yang dipertimbangkan adalah satuan massa cairan, maka modulus elastisitas K dapat dinyatakan dalam persamaan :
Karena ρV = tetap dan d(ρV) = 0 atau dV/V = -dρ/ρ
Kapilaritas
Kapilaritas terjadi disebabkan oleh tegangan permukaan oleh gaya kohesi dan adhesi. hal ini dapat dilihat dari suatu pipa vertikal diameter kecil (pipa kapiler) yang dimasukkan ke dalam suatu cairan.
Keseimbangan tercapai apabila :
Sehingga kenaikan kapilaritas dapat dihitung yaitu :
(Persamaan diatas berlaku untuk d < 3 mm)
dimana :
h = tinggi kenaikan kapilaritas (m)
σ = tegangan permukaan (N/m2)
ρ = kerapatan cairan (kg/m3)
g = gaya grafitasi (m/s2)
d = diameter pipa kapiler (m)
Ѳ = sudut antara tegangan permukaan dan dinding pipa vertikal
Tekanan
Tekanan fluida yaitu gaya fluida yang bekerja pada arah tegak lurus pada satuan luas permukaan P = F/A
Tekanan Uap
Salah satu cara untuk menjelaskan besarnya tekanan uap, diambil suatu pipa diamter kecil berisi cairan yang ditutup di salah satu ujungnya (tube). Ujung yang satu lagi terbuka dan dibenamkan di dalam suatu bak berisi cairan yang sama dengan cairan di dalam pipa, seperti pada gambar di bawah ini.
Tekanan atmosfer menahan menahan kolom cairan di dalam pipa, tetapi apabila pipa ditarik lebih tinggi, tekanan di ujung atas pipa menurun sampai di bawah tekanan uap. Dalam hal ini cairan akan melepaskan diri dari ujung pipa. Dengan tekanan pada permukaan dasar pipa sama dengan tekanan atmosfer, Keseimbangan gaya dapat digunakan untuk menunjukkan hubungan antara tekanan uap, tekanan atmosfer dan panjang dari kolom cairan :
Pu A = Patm Aγ(hA)
dimana :Pu = tekanan uap dalam Pa (Pascal)
Patm = tekanan atmosfer
A = luas penampang pipa
γ = berat jenis cairan
Gaya, Massa dan Berat
Gaya adalah dorongan / pendorong yang dapat menyebabkan benda bergerak dari suatu tempat ketempat lainnya.
Massa adalah ukuran jumlah suatu materi.
Berat adalah gaya yang disebabkan oleh gaya grafitasi
dimana :
Percepata Grafitasi = gc = 32,174 lbm . ft/lbf . s2 (faktor konversi)
jadi percepatan grafitasi = g = 32,174 ft/s2
Contoh :
Sebuah benda dengan berat 200 lbf berada disuatu tempat dibumi yang mempunyai percepatan grafitasi sebesar 32,2 ft/s2 . Berapakah berat benda tersebut dipermukaan bulan yang memiliki percepatan grafitasi 5,47 ft/s2
Jawab :
F = (m. g)/gc
m = (F . gc)/g = (200 x 32,174)/32,2 = 199,84 lb
F = (m . g)/gc = (199,84 x 5,47)/32,174 = 33,97 lbf
Tekanan Relatif (Gage/Gaoge)
Tekanan Relatif adalah tekanan didalam sistem tersebut, dengan tidak menyertakan besarnya tekanan atmosfer.
Aliran Fluida
Aliran terbagi menjadi dua yaitu aliran laminer (aliran berlapis) dan aliran turbulen (aliran bergolak)
Aliran laminer : aliran lambat, ρ rendah, viskositas tinggi dan profil aliran berbentuk parabola.
Bilangan Renold (NRe)
Jenis aliran yang merupakan fungsi dari :
- Kecepatan alir fluida (υ)
- Viskositas (µ)
- Rapat Massa (ρ)
- Diameter pipa (D)
NRe < 2100 (laminer)
NRe >4000 (turbulen)
Kehilangan Energi karena Gesekan dipengaruhi oleh :
Sifat fluida (viskositas).
Sifat aliran (laminer/turbulen).
Sistem pipa.
Alat Ukur Fluida :
Tabung pitot
Venturi meter
Oriffice
Pemberian energi mekanis dengan meggunakan pompa, fan, blower, kompresor pada fluida untuk :
- Menambah tekanan
- Menambah kecepatan
- Menambah tinggi posisi
- Kapasitas
- Kebutuhan daya
- Efisiensi
- Reliability dan Maintenance