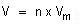Definisi Mol
- Satu mol adalah banyaknya zat yang mengandung jumlah partikel yang = jumlah atom yang terdapat dalam 12 gram C-12.
- Mol merupakan satuan jumlah (seperti lusin,gros), tetapi ukurannya jauh lebih besar.
- Mol menghubungkan massa dengan jumlah partikel zat.
Hubungan mol dengan jumlah partikel, Kemolaran, Massa, Volum gas dapat digambarkan sebagai berikut:
- Jumlah partikel dalam 1 mol (dalam 12 gram C-12) yang ditetapkan melalui berbagai metode eksperimen dan sekarang ini kita terima adalah 6,02 x 10 23 (disebut tetapan Avogadro, dinyatakan dengan L ).
1 mol air artinya : sekian gram air yang mengandung 6,02 x 10 23 molekul air.
1 mol besi artinya : sekian gram besi yang mengandung 6,02 x 10 23 atom besi.
1 mol asam sulfat artinya : sekian gram asam sulfat yang mengandung 6,02 x 10 23 molekul H 2 SO 4 .
1 mol = 6,02 x 10 23 partikel
L = 6,02 x 10 23
Hubungan Mol dengan Jumlah Partikel
Dirumuskan :
Keterangan :
n = jumlah mol
x = jumlah partikel
Massa Molar (m)
- Massa molar menyatakan massa 1 mol zat.
- Satuannya adalah gram mol -1 .
- Massa molar zat berkaitan dengan Ar atau Mr zat itu, karena Ar atau Mr zat merupakan perbandingan massa antara partikel zat itu dengan atom C-12.
Contoh :
zAr Fe = 56, artinya : massa 1 atom Fe : massa 1 atom C-12 = 56 : 12
Mr H 2 O = 18, artinya : massa 1 molekul air : massa 1 atom C-12 = 18 : 12
Karena :
1 mol C-12 = 12 gram (standar mol), maka :
1 mol C-12 = 12 gram (standar mol), maka :
Kesimpulan :
Massa 1 mol suatu zat = Ar atau Mr zat tersebut (dinyatakan dalam gram).
Untuk unsur yang partikelnya berupa atom : mm = Ar gram mol -1
Untuk zat lainnya : mm = Mr gram mol -1
Hubungan Jumlah Mol (n) dengan Massa Zat (m)
Dirumuskan :
dengan :
m = massa
n = jumlah mol
mm = massa molar
Volum Molar Gas (Vm )
- Adalah volum 1 mol gas.
- Menurut Avogadro, pada suhu dan tekanan yang sama, gas-gas bervolum sama akan mengandung jumlah molekul yang sama pula.
- Artinya, pada suhu dan tekanan yang sama, gas-gas dengan jumlah molekul yang sama akan mempunyai volum yang sama pula.
- Oleh karena 1 mol setiap gas mempunyai jumlah molekul sama yaitu 6,02 x 10 23 molekul, maka pada suhu dan tekanan yang sama, 1 mol setiap gas mempunyai volum yang sama.
- Jadi : pada suhu dan tekanan yang sama, volum gas hanya bergantung pada jumlah molnya.
Dirumuskan :
dengan :
V = volum gas
n = jumlah mol
Vm = volum molar
Beberapa kondisi / keadaan yang biasa dijadikan acuan :
Keadaan Standar
Adalah suatu keadaan dengan suhu 0 o C dan tekanan 1 atm.
Adalah suatu keadaan dengan suhu 0 o C dan tekanan 1 atm.
Dinyatakan dengan istilah STP ( Standard Temperature and Pressure ).
Pada keadaan STP, volum molar gas ( Vm ) = 22,4 liter/mol.
Keadaan Kamar
Adalah suatu keadaan dengan suhu 25 o C dan tekanan 1 atm.
Dinyatakan dengan istilah RTP (Room Temperature and Pressure).
Dinyatakan dengan istilah RTP (Room Temperature and Pressure).
Pada keadaan RTP, volume molar gas (Vm) = 24 liter/mol.
Keadaan Tertentu dengan Suhu dan Tekanan yang Diketahui
Digunakan rumus Persamaan Gas Ideal :
Keadaan Tertentu dengan Suhu dan Tekanan yang Diketahui
Digunakan rumus Persamaan Gas Ideal :
P = tekanan gas (atm) ; 1 atm = 76 cmHg = 760 mmHg
V = volum gas (L)
n = jumlah mol gas
R = tetapan gas (0,082 L atm/mol K)
T = suhu mutlak gas (dalam Kelvin = 273 + suhu Celcius)
V = volum gas (L)
n = jumlah mol gas
R = tetapan gas (0,082 L atm/mol K)
T = suhu mutlak gas (dalam Kelvin = 273 + suhu Celcius)
Keadaan yang Mengacu pada Keadaan Gas Lain
Gas B dengan jumlah mol = n2 dan volum = V2
Maka pada suhu dan tekanan yang sama :
Kemolaran Larutan (M)
Kemolaran adalah suatu cara untuk menyatakan konsentrasi (kepekatan) larutan.
Menyatakan jumlah mol zat terlarut dalam tiap liter larutan, atau jumlah mmol zat terlarut dalam tiap mL larutan .
Dirumuskan :
dengan :
M = kemolaran larutan
n = jumlah mol zat terlarut
V = volum larutan
Misalnya : larutan NaCl 0,2 M artinya, dalam tiap liter larutan terdapat 0,2 mol (= 11,7 gram) NaCl atau dalam tiap mL larutan terdapat 0,2 mmol (= 11,7 mg) NaCl.
Dibawah ini adalah jenis zat terlarut dan zat pelarut berserta contohnya
Dibawah ini adalah jenis zat terlarut dan zat pelarut berserta contohnya
Zat Terlarut Zat Pelarut Contoh
Gas Gas Udara
Gas Cair CO2 larut dalam air
Gas Padat Gas H2 terabsopsi karbondioksida
Cair Gas Embun pagi
Cair Cair Etanol dalam air
Cair Padat Hg/Pb (amalgam)
Padat Gas Debu
Padat Cair Garam - garam dalam air NaCl
Padat Padat Ag/Pt (Alloy)
%W = ((gram zat terlaru/gram larutan)) x 100
%V = ((liter zat terlarut/gram larutan)) x 100
%W/V = ((gram zat terlarut/liter larutan)) x 100
M(molar) = mol zat terlarut/liter larutan = n/liter larutan = (gr/Mr) / liter larutan
= gr/(Mr/L)
m(molal) = mol zat terlarut / 1000 gr larutan
N(normal) = ekivalen zat terlarut / liter larutan
F(formal) = massa rumus zat terlarut / (liter larutan)
X(fraksi mol) = mol zat terlarut /(mol zat terlarut + mol pelarut)
= n1 /(n1 + n2)
ppm(part permillion) = mg zat terlarut / kg zat pelarut
= 10-2 gram
= 103 gram
= 10-6