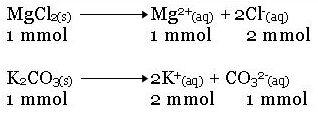Elektrolisa adalah reaksi non-spontan yang berjalan akibat adanya arus (aliran elektron) eksternal yang dihasilkan oleh suatu pembangkit listrik.
Pada sel elektrolitik
- Katoda bermuatan negatif atau disebut elektroda (–)
- Terjadi reaksi reduksi
- Jenis logam tidak diperhatikan, kecuali logam Alkali (IA) dengan Alkali tanah(IIA), Al dan Mn.
- Reaksi : 2 H+(aq) + 2e- →H2(g) ion golongan IA/IIA tidak direduksi; dan penggantinya air 2 H2O(l) + 2 e- → basa + H2(g) ion-ion lain direduksi.
- Anoda bermuatan positif (+) atau disebut elektroda +
- Terjadi reaksi oksidasi
- Jenis logam diperhatikan
Anoda : Pt atau C (elektroda inert)
reaksi :- 4OH- (aq) → 2H2O(l) + O2(g) + 4e-
- Gugus asam beroksigen tidak teroksidasi, diganti oleh 2 H2O(l) → asam + O2(g)
- Golongan VIIA (halogen) → gas
Anoda bukan : Pt atau C
reaksi : bereaksi dengan anoda membentuk garam atau senyawa lain.
Dalam Elektrolisa terdapat tiga sel, yaitu :- Sel Volta atau Galvani
- Sel Daniel
- Sel Elektrolisis
Keempat sel elektrolisa diatas, sebelah kiri sel (anoda) terjadi oksidasi dan sebelah kanan (katoda) terjadi reduksi.
Sel Volta, Daniel, dan Galvani : Anoda negatif (-) dan katoda positif (+)
Sel Elektrolisis : Anoda positif (+) dan katoda negatif (-)
DGL standard = Eo = Eokatoda - Eoanoda (harus positif untuk R spontan)
T = 25oC, P = 1 atm
Jika DGL < 0 bernilai negatif (-), maka R nonspontan.
Syaratnya :
- Suatu reaksi berlangsung spontan jika DGL>0
- Energi bebas ∆Go yang diharapkan agar reaksi berjalan maka ∆Go< 0 atau (-).
∆Go pada kesetimbangan yaitu : -RT ln K atau
∆Go = -nFE (larutan elektrolit atau mengandung listrik)
Persamaan Nerts :
∆Go = -RT ln K
∆Go = -nFE
∆Go = ∆Go
-nFE = -RT ln K
Sel Volta atau Galvani
Sel Volta atau sel galvani adalah sel elektrokimia yang melibatkan raksi redoks dan menghasilkan arus listrik. Kegunaannya adalah untuk mengukur pH kelarutan.
Sel volta terdiri atas elektroda tempat berlangsungnya reaksi oksidasi disebut anoda(electrode negative), dan tempat berlangsungnya reaksi reduksi disebut katoda(electrode positif).
Susunan sel Volta adalah :
Notasi sel : Y / ion Y // ion X / X
Logam X mempunyai potensial reduksi yang lebih positip dibanding logam Y , sehingga logam Y bertindak sebagai anoda dan logam X bertindak sebagai katoda.
Jembatan garam mengandung ion-ion positif dan ion-ion negative yang berfungsi menetralkan muatan positif dan negative dalam larutan elektrolit.
Contoh :
Hitunglah beda potensial sel reaksi redok berikut :
a. Zn / Zn2+ // Ag+ / Ag
b. Zn / Zn2+ 0,2 M // Cu2+ 0,1 M // CuJawab :
Gunakan rumus : Eosel = Ekatoda – E anoda
= + 0,80 – ( – 0,76) = + 1,56 volt
Gunakan rumus :
= +0,34 – ( – 0,76 ) + (0,059/2) log (0,2 / 0,1)
= + 1,4285 volt
Sel Daniel
Pada Sel Daniel, elektroda Cu dibenamkan dalam larutan tembaga(II) sulfat atau CuSO4 dan elektroda seng sulfat atau ZnSO4.Pada anoda, Zn mengalami oksidasi:
Pada katoda, Cu mengalami reduksi:
Cu2+(aq) + 2e- → Cu(s)

Pada sel Daniell, kawat dan lampu dihubungkan dengan kedua elektroda. Elektron-elektron yang "ditarik" dari seng berjalan sepanjang kawat, yang harus merupakan kawat non-reaktif, menghasilkan arus listrik yang membuat lampu menyala. Pada sel seperti ini, ion-ion sulfat memainkan peranan penting. Setelah bermuatan negatif, anion-anion ini terkumpul di anoda untuk mempertahankan keseimbangan muatan. Sebaliknya, pada katoda ion-ion Cu2+ terakumulasi untuk mempertahankan keseimbangan muatan ini. Kedua proses ini menyebabkan sebagian tembaga terakumulasi di katoda dan elektroda seng menjadi "terlarut" atau "meluruh" ke dalam larutan. Karena kedua reaksi tidak terjadi sendiri-sendiri (independently), kedua sel harus dihubungkan (dengan konduktor misalnya) agar ion-ion bergerak bebas. Digunakan dua wadah keramik yang berbeda untuk masing-masing larutan. Biasanya suatu "salt bridge" atau jembatan garam digunakan untuk menghubungkan kedua sel. Pada sel basah seperti ini, ion-ion sulfat bergerak dari katoda menuju anoda melalui jembatan garam dan kation-kation Zn2+ bergerak dalam arah sebaliknya.
Sel Elektrolisis
Sel Elektrolisis merupakan proses kimia yang mengubah energi listrik menjadi energi kimia. Komponen yang terpenting dari proses elektrolisis ini adalah elektroda dan elektrolit.
Elektroda yang digunakan dalam proses elektolisis dapat digolongkan menjadi dua, yaitu:
- Elektroda inert, seperti kalsium (Ca), potasium, grafit (C), Platina (Pt), dan emas (Au).
- Elektroda aktif, seperti seng (Zn), tembaga (Cu), dan perak (Ag).
Elektrolitnya dapat berupa larutan berupa asam, basa, atau garam, dapat pula leburan garam halida atau leburan oksida. Kombinasi antara elektrolit dan elektroda menghasilkan tiga kategori penting elektrolisis, yaitu:
- Elektrolisis larutan dengan elektroda inert
- Elektrolisis larutan dengan elektroda aktif
- Elektrolisis leburan dengan elektroda inert
Pada elektrolisis, katoda merupakan kutub negatif dan anoda merupakan kutub positif. Pada katoda akan terjadi reaksi reduksi dan pada anoda terjadi reaksi oksidasi.
Dalam sel, reaksi oksidasi reduksi berlangsung dengan spontan, dan energi kimia yang menyertai reaksi kimia diubah menjadi energi listrik. Bila potensial diberikan pada sel dalam arah kebalikan dengan arah potensial sel, reaksi sel yang berkaitan dengan negatif potensial sel akan diinduksi. Dengan kata lain, reaksi yang tidak berlangsung spontan kini diinduksi dengan energi listrik. Proses ini disebut elektrolisis. Pengecasan baterai timbal adalah contoh elektrolisis.
Reaksi total sel Daniell adalah
Zn + Cu2+(aq) –> Zn2+(aq) + Cu
Andaikan potensial lebih tinggi dari 1,1 V diberikan pada sel dengan arah kebalikan dari potensial yang dihasilkan sel, reaksi sebaliknya akan berlangsung. Jadi, zink akan mengendap dan tembaga akan mulai larut.
Zn2+(aq) + Cu –> Zn + Cu2+(aq)
Rangkaian sel elektrolisis hampir menyerupai sel volta. Yang membedakan sel elektrolisis dari sel volta adalah, pada sel elektrolisis, komponen voltmeter diganti dengan sumber arus (umumnya baterai). Larutan atau lelehan yang ingin dielektrolisis, ditempatkan dalam suatu wadah. Selanjutnya, elektroda dicelupkan ke dalam larutan maupun lelehan elektrolit yang ingin dielektrolisis. Elektroda yang digunakan umumnya merupakan elektroda inert, seperti Grafit (C), Platina (Pt), dan Emas (Au). Elektroda berperan sebagai tempat berlangsungnya reaksi. Reaksi reduksi berlangsung di katoda, sedangkan reaksi oksidasi berlangsung di anoda. Kutub negatif sumber arus mengarah pada katoda (sebab memerlukan elektron) dan kutub positif sumber arus tentunya mengarah pada anoda. Akibatnya, katoda bermuatan negatif dan menarik kation-kation yang akan tereduksi menjadi endapan logam. Sebaliknya, anoda bermuatan positif dan menarik anion-anion yang akan teroksidasi menjadi gas. Terlihat jelas bahwa tujuan elektrolisis adalah untuk mendapatkan endapan logam di katoda dan gas di anoda.

Dalam elektrolisis Massa unsur yang diendapkan dikatoda = (i . t . (Ar/n))/965 Dalam suatu kesetimbangan Esel = 0, naka nilai K dapat dicari yaitu :
Hubungan elektroda dengan elektrolit sekitarnya (Liquid Jungtion) disebut setengah sel.
Ag, AgCl | HCl, 0,1 M | gelas | larutan | kalomel
Dengan menggunakan voltmeter Egelas = 0,800 Vjadi : 0,800 V = 0,280 + 0,05915 pH
pH = (0,800 - 0,280)/0,05915
Sel Konsentrasi :
Pada Sel Volta (Galvani) dan Daniel yang mengalami oksidasi dan reduksi terletak pada konsentrasinya, yang mempunyai konsentrasi encer yaitu mengalami oksidasi (anoda), sedangkan konsentrasi pekat mengalami reduksi (katoda).