Dalam sebuah reaksi kimia, kita mengenal ada dua reaksi dasar yaitu reaksi maju dan reaksi balik. Reaksi maju adalah reaksi yang terjadi pada saat kita melakukan perubahan dari bentuk dasar ke bentuk lainnya. Sedangkan reaksi balik adalah reaksi yang kita lakukan untuk mengembalikan bentuk zat ke bentuk awalnya. Dalam kondisi inilah dapat terjadi Kesetimbangan kimia antara reaksi awal (maju) dengan reaksi baliknya.
Kesetimbangan kimia adalah satu kondisi yang dicapai dalam sebuah reaksi kimia yang terjadi secara seimbang dalam lajunya pada saat reaksi maju dan reaksi baliknya. Dengan kesetimbangan kimia ini, maka kita dapat melakukan proses balik pada zat - zat yang ada sehingga terbentuk kembali zat dasarnya.
Proses Perubahan Kesetimbangan dalam Proses Kimia
Pada proses - proses kimia, seringkali kita mengalami perubahan kondisi sedemikian rupa sehingga hal tersebut dapat menyebabkan terganggunya kesetimbangan yang telah terbentuk dalam reaksi kimia. Untuk kondisi tersebut, maka secara cepat zat yang mengalami proses kimia melakukan penyesuaian diri dengan melakukan pergeseran kesetimbangan.
Dalam kehidupan kita sehari - hari peristiwa kimia ini dapat kita jumpai pada kegiatan hidup kita. Misalnya ketika memanaskan air dalam ketel atau bejana tertutup lainnya, pada saat air dipanaskan, karena suhu terus meningkat, maka air menguap. Hal ini karena ruangan di dalam ketel suhunya meningkat. Tetapi ketika suhu terus meningkat, maka hal tersebut menyebabkan meningkatnya tekanan dalam ketel, maka pada saat itulah uap air akan berubah menjadi air lagi melalui proses pengembunan.
Proses ini akan dilakukan oleh air dalam bejana tersebut hingga tercipta kesetimbangan dalam ruangan atau bejan tertutup yang ditempatinya. Begitu juga yang terjadi di alam terbuka. Peristiwa penguapan air, hujan dan pengembunan di pagi hari merupakan proses kimia yang menerapkan kesetimbangan kimia di alam.
Kesimpulannya :
Kesetimbangan kimia terjadi pada saat Anda memiliki reaksi timbal balik di sebuah sistem tertutup. Tidak ada yang dapat ditambahkan atau diambil dari sistem itu selain energi. Pada kesetimbangan, jumlah dari segala sesuatu yang ada di dalam campuran tetap sama walaupun reaksi terus berjalan. Ini dimungkinkan karena kecepatan reaksi ke kanan dan ke kiri sama.
Apabila Anda mengubah keadaan sedemikian rupa sehingga mengubah kecepatan relatif reaksi ke kanan dan ke kiri, Anda akan mengubah posisi kesetimbangan, karena Anda telah mengubah faktor dari sistem itu sendiri.
Dalam hal ini kita akan membahas kesetimbangan kimia dalam analisis Titrimetri. Analisis Titrimetri biasanya menggunakan pelarut air, misalnya :
Kesetimbangan kimia adalah satu kondisi yang dicapai dalam sebuah reaksi kimia yang terjadi secara seimbang dalam lajunya pada saat reaksi maju dan reaksi baliknya. Dengan kesetimbangan kimia ini, maka kita dapat melakukan proses balik pada zat - zat yang ada sehingga terbentuk kembali zat dasarnya.
Proses Perubahan Kesetimbangan dalam Proses Kimia
Pada proses - proses kimia, seringkali kita mengalami perubahan kondisi sedemikian rupa sehingga hal tersebut dapat menyebabkan terganggunya kesetimbangan yang telah terbentuk dalam reaksi kimia. Untuk kondisi tersebut, maka secara cepat zat yang mengalami proses kimia melakukan penyesuaian diri dengan melakukan pergeseran kesetimbangan.
Dalam kehidupan kita sehari - hari peristiwa kimia ini dapat kita jumpai pada kegiatan hidup kita. Misalnya ketika memanaskan air dalam ketel atau bejana tertutup lainnya, pada saat air dipanaskan, karena suhu terus meningkat, maka air menguap. Hal ini karena ruangan di dalam ketel suhunya meningkat. Tetapi ketika suhu terus meningkat, maka hal tersebut menyebabkan meningkatnya tekanan dalam ketel, maka pada saat itulah uap air akan berubah menjadi air lagi melalui proses pengembunan.
Proses ini akan dilakukan oleh air dalam bejana tersebut hingga tercipta kesetimbangan dalam ruangan atau bejan tertutup yang ditempatinya. Begitu juga yang terjadi di alam terbuka. Peristiwa penguapan air, hujan dan pengembunan di pagi hari merupakan proses kimia yang menerapkan kesetimbangan kimia di alam.
Kesimpulannya :
Kesetimbangan kimia terjadi pada saat Anda memiliki reaksi timbal balik di sebuah sistem tertutup. Tidak ada yang dapat ditambahkan atau diambil dari sistem itu selain energi. Pada kesetimbangan, jumlah dari segala sesuatu yang ada di dalam campuran tetap sama walaupun reaksi terus berjalan. Ini dimungkinkan karena kecepatan reaksi ke kanan dan ke kiri sama.
Apabila Anda mengubah keadaan sedemikian rupa sehingga mengubah kecepatan relatif reaksi ke kanan dan ke kiri, Anda akan mengubah posisi kesetimbangan, karena Anda telah mengubah faktor dari sistem itu sendiri.
Dalam hal ini kita akan membahas kesetimbangan kimia dalam analisis Titrimetri. Analisis Titrimetri biasanya menggunakan pelarut air, misalnya :
Untuk larutan, konsentrasi dinyatakan dalam mol/L (M) atau molal (m)
Larutan : Molar = mol/L
molal = (W1/Mr) x (1000/W2)
Gas : molal dan Tekanan
Reaksi - reaksi pada Kesetimbangan Kimia :
Tetapan air (Kw) pada berbagai suhu
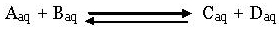



artikel diatas sudah bagus, namun alangkah baiknya contoh fenomenanya ditambahin lagi biar lebih bagus :) good job
BalasHapus