Jika kita menambahkan ion senama ke dalam larutan jenuh yang berada pada kesetimbangannya, maka kesetimbangan akan bergeser ke kiri membentuk endapan. Terbentuknya endapan ini menunjukkan penurunan kelarutan. Fenomena ini disebut efek ion senama .
Jika larutan jenuh AgCl ditambahkan HCl, maka kesetimbangan AgCl akan terganggu.
HCl (aq) → H + (aq) + Cl - (aq)
AgCl (s) D Ag + (aq) + Cl - (aq)
Kehadiran Cl - pada reaksi ionisasi HCl menyebabkan konsentrasi Cl - pada kesetimbangan bergeser ke kiri membentuk endapan AgCl. Dengan demikian kelarutan menjadi berkurang.
Tetapan Kesetimbangan Kelarutan (Ksp) adalah tetapan perkalian kelarutan yang dinyatakan kelarutan endapan dalam air.
Contoh :
Hitung Ksp dari Barium Sulfat jika Mr = 233 pada 25oC :
Jawab :
Kelarutan BaSO4 = 0,00023 gram/100 ml
= 0,23 mg/100 ml
(0,0023 mg/ml)/(233 mg mmol) = 9,871 x 10-6 = 1,0 x 10-5 mmol/ml
Ksp BaSO4 = [Ba2+][SO42-]
Ksp BaSO4 = S2 = (1,0 x 10-5)2 = 1 x 10-10
Memprediksi Adanya Pengendapan
Masing-masing zat memiliki harga Ksp yang berbeda. Selanjutnya, dengan mengetahui harga Ksp dari suatu zat, kita dapan memperkirakan keadaan ion-ion suatu zat dalam suatu larutan dengan ketentuan sebagai berikut.
- jika hasil kali konsentrasi ion-ion (Qc) lebih kecil dan harga K sp maka ion-ion tersebut masih larut.
- Jika hasil kali konsentrasi ion-ion (Qc) sama dengan harga K sp maka ion-ion tersebut tepat jenuh.
- Jika hasil kali konsentrasi ion-ion (Qc) lebih besar harga K sp maka ion-ion tersebut sudah membentuk endapan.
100 ml larutan MgCl 2 0,01 M dicampurkan dengan 100 ml K 2 CO 3 0,001 M. Jika Ksp MgCO 3 = 3,5 x 10 -5, apakah MgCO 3 yang terbentuk sudah mengendap?
Jawab :
Setelah dicampur, volume campuran adalah 200 ml
Karena Qc MgCO3<Ksp MgCO3, maka MgCO3 tidak mengendap.

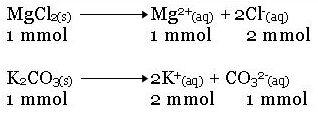

Tidak ada komentar:
Posting Komentar